ANSM - Mis à jour le : 06/07/2020
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyseChlorure de calcium dihydraté, Chlorure de magnésium hexahydraté, Glucose monohydrate, solution d’acide lactique 90% m/m, Chlorure de sodium, Chlorure de potassium, Bicarbonate de sodium Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse ?
3. Comment utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
6. Contenu de l’emballage et autres informations.
Classe pharmacothérapeutique : solutions pour hemodialyse et hemofiltration. - code ATC : B05ZB.
PRISMASOL 2 mmol/l Potassium est utilisée dans le traitement de l’insuffisance rénale comme solution pour l’hémofiltration ou l’hémodiafiltration continue (en remplacement du volume de liquide éliminé du sang lorsqu’il passe au travers d’un filtre), ainsi que pour l’hémodiafiltration et l’hémodialyse continue (le sang circule d’un côté de la membrane de dialyse tandis qu’une solution d’hémodialyse circule de l’autre côté de la membrane).
La solution PRISMASOL 2 mmol/l Potassium peut également être utilisée dans le cas d’empoisonnement par des substances dialysables ou filtrables.
La solution PRISMASOL 2 mmol/l Potassium est particulièrement indiquée pour les patients ayant une tendance à l’hyperkaliémie (concentration élevée de potassium dans le sang).
N’utilisez jamais PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse dans les cas suivants:· allergie à l’une des substances actives ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6
· faible concentration de potassium dans votre sang (hypokaliémie).
· concentration élevée de bicarbonate dans le sang (alcalose métabolique).
La présence d’antigène de maïs dans PRISMASOL 2 mmol/l POTASSIUM ne peut être exclue. N’utilisez pas la technique d’hémofiltration/dialyse dans les cas suivants :Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser ce médicament.
Ce médicament doit seulement être utilisé par ou sous la responsabilité d’un médecin qualifié dans le traitement de l’insuffisance rénale utilisant les techniques d’hémofiltration, d’hémodiafiltration ou d’hémodialyse continue.
Avant et pendant le traitement, la composition de votre sang sera contrôlée dont notamment l'équilibre acido-basique et la concentration des électrolytes (sels dans le sang), ainsi que tous les liquides que vous recevez (par perfusion intraveineuse) et ceux que vous produisez (urine), même s’ils ne sont pas directement liés au traitement.
Votre concentration de sucre dans le sang doit faire l’objet d’une surveillance attentive, en particulier si vous êtes diabétique.
Autres médicaments et PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyseInformez votre médecin ou pharmacien si vous recevez, avez récemment reçu ou pourriez recevoir un autre médicament.
La concentration sanguine de certains de vos médicaments peut être réduite au cours du traitement. Il appartiendra à votre médecin de déterminer si votre prescription doit être modifiée.
En particulier, informez votre médecin dans les cas suivants :
Sans objet.
Grossesse, allaitement et fertilitéSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Votre médecin prescripteur déterminera la nécessité d’un traitement par PRISMASOL 2 mmol/l Potassium si vous êtes enceinte ou allaitez.
Conduite de véhicules et utilisation de machinesPRISMASOL n’est pas connu pour affecter l’aptitude à conduire un véhicule ou à utiliser des machines.
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse contientSans objet.
3. COMMENT UTILISER PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
Posologie et administrationLe volume de solution PRISMASOL 2 mmol/l Potassium à administrer dépend de votre état clinique et de l’équilibre liquidien souhaité. Par conséquent, le volume à administrer est à l’appréciation du médecin traitant.
Voie d’administration : Voie intraveineuse et pour hémodialyse.
Si vous pensez avoir utilisé plus de PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse que vous n’auriez dû :Votre balance hydro-électrolytique et votre équilibre acido-basique seront surveillés attentivement.
Dans le cas peu probable d’un surdosage, votre médecin prendra les mesures correctives qui s’imposent et ajustera votre traitement.
Un surdosage peut causer :
Un surdosage peut avoir des conséquences graves, comme une insuffisance cardiaque congestive, des troubles électrolytiques ou acido-basiques.
Pour le mode d’emploi, veuillez-vous reporter à la rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de santé ».
Si vous oubliez d’utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse : Si vous arrêtez d’utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse :Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas conserver à une température inférieure à +4°C.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à 22°C. Si la solution n’est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures, incluant la durée du traitement.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
AVANT RECONSTITUTION
1000 ml de solution d'électrolytes (petit compartiment A) contiennent :
Chlorure de calcium dihydraté ..................................................................................................... 5,145 g
Chlorure de magnésium hexahydraté ......................................................................................... 2,033 g
Glucose ..................................................................................................................................... 22,000 g
(S)-Acide lactique ........................................................................................................................ 5,400 g
1000 ml de solution tampon (grand compartiment B) contiennent :
Chlorure de sodium ..................................................................................................................... 6,450 g
Bicarbonate de sodium ................................................................................................................ 3,090 g
Chlorure de potassium ................................................................................................................. 0,157 g
APRES RECONSTITUTION
Les solutions des compartiments A (250 ml) et B (4750 ml) sont mélangées pour former la solution reconstituée (5000 ml) dont la formule est:
|
mmol/l |
mEq/l |
|
|
Calcium - Ca2+ |
1,75 |
3,50 |
|
Magnésium - Mg2+ |
0,50 |
1,00 |
|
Sodium - Na+ |
140,00 |
140,00 |
|
Chlorure - Cl- |
111,50 |
111,50 |
|
Lactate |
3,00 |
3,00 |
|
Bicarbonate - HCO3 - |
32,00 |
32,00 |
|
Potassium- K+ |
2,00 |
2,00 |
|
Glucose |
6,10 |
Osmolarité théorique: 297 mOsm/l
Dioxyde de carbone (E 290), eau pour préparations injectables.
pH de la solution reconstituée: 7.0 – 8.5.
Qu’est-ce que PRISMASOL 2 mmol/l POTASSIUM et contenu de l’emballage extérieur
PRISMASOL 2 mmol/l POTASSIUM se présente sous la forme d'une poche à deux compartiments. Le petit compartiment A contient la solution électrolytique et le grand compartiment B contient la solution tampon. La solution reconstituée finale est obtenue après avoir cassé le cône ou ouvert la soudure pelable inter-compartiment et mélangé les deux solutions. La solution reconstituée est limpide, légèrement colorée en jaune. Chaque poche (A+B) contient 5 000 ml de solution pour hémofiltration et hémodialyse. La poche est suremballée dans un emballage transparent.
Chaque carton contient deux poches et une notice.
Titulaire de l’autorisation de mise sur le marché
BAXTER HOLDING B.V.KOBALTWEG 49
3542CE UTRECHT
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
BAXTER SASIMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FRANCE
BIEFFE MEDITAL S.P.A.VIA STELVIO, 94
23035 SONDALO (SO)
ITALIE
Ou
BAXTER HEALTHCARE S.A.MONEEN ROAD,
CASTLEBAR
COUNTY MAYO
F23 XR63
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[à compléter ultérieurement par le titulaire]La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialysePrécautionsIl convient de suivre rigoureusement les instructions d’utilisation/de manipulation de PRISMASOL 2 mmol/l POTASSIUM.
Les solutions dans les deux compartiments doivent être mélangées avant utilisation.
L’utilisation d’une solution pour hémofiltration et hémodialyse contaminée peut entraîner une septicémie avec état de choc et menacer le pronostic vital.
Prismasol peut être réchauffé à 37 C pour améliorer le confort du patient. Le réchauffement de la solution avant son utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Les solutions ne doivent pas être réchauffées au bain-marie ni au four à micro-ondes. La solution doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l’administration, si la solution et le contenant le permettent. N’administrer la solution que si elle est limpide et la soudure est intacte.
La solution contient du potassium. La concentration sérique de potassium doit être surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse. En fonction de la concentration plasmatique de potassium avant le traitement, une hypo- ou hyperkaliémie peut survenir.
En cas d’apparition d’une hypokaliémie, l’ajout de potassium et /ou l’administration d’une solution de dialysat avec une concentration élevée en potassium pourra être nécessaire.
En cas d’apparition d’une hyperkaliémie après le début du traitement, l’ajout de sources de potassium influençant les concentrations sanguines pourra être évaluée. Lorsque la solution est utilisée comme solution de substitution, réduire le débit de perfusion et vérifier l'obtention de la concentration de potassium désirée. Si l'hyperkaliémie persiste, interrompre rapidement l'administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Prismasol comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
La concentration de phosphate inorganique doit être mesurée régulièrement. Le phosphate inorganique doit être substitué en cas de faible taux de phosphate dans le sang. Il est possible d’ajouter à la solution jusqu’à 1,2 mmol/L de phosphate. En cas d’ajout de phosphate de potassium, la concentration totale en potassium ne doit pas dépasser 4 mEq/L (4 mmol/L).
Même si aucun cas de réactions graves d’hypersensibilité au maïs n’est reporté avec PRISMASOL 2 mmol/L POTASSIUM ; la solution, contenant du glucose dérivé d’amidon de maïs hydrolysé, ne doit pas être utilisée chez les patients ayant une allergie connue au maïs ou aux produits contenant du maïs.
L’administration doit être immédiatement stoppée en cas d’apparition de signe ou symptômes d’une éventuelle réaction d’hypersensibilité. Les mesures thérapeutiques appropriées doivent être instaurées selon l’état clinique du patient.
Etant donné que la solution contient du glucose et du lactate, une hyperglycémie peut survenir, en particulier chez les patients diabétiques. La glycémie doit être régulièrement surveillée. En cas d’hyperglycémie, l’administration d’une solution de substitution / dialysat sans glucose pourra être nécessaire. D’autres mesures correctives pourront être nécessaires pour maintenir la glycémie au niveau souhaité.
PRISMASOL 2 mmol/L POTASSIUM contient un hydrogénocarbonate (bicarbonate) et du lactate (un précurseur du bicarbonate), qui peuvent influencer l’équilibre acido-basique du patient. Si une alcalose métabolique se développe ou s’aggrave pendant le traitement avec la solution, il est possible que le débit de perfusion doive être réduit ou que l’administration doive être interrompue.
Avant et pendant toute la durée du traitement, l’équilibre électrolytique et l’équilibre acido-basique du patient doivent être étroitement surveillés.
En cas de déséquilibre hydrique, l’état clinique doit être surveillé attentivement et l’équilibre hydrique doit être rétabli au besoin.
Mode d’administrationVoie intraveineuse et pour hémodialyse.
La solution PRISMASOL 2 mmol/L POTASSIUM lorsqu'elle est utilisée en tant que solution de substitution, est administrée dans le circuit extracorporel en amont (pré dilution) ou en aval de l’hémofiltre (post dilution).
PosologieLe volume et le débit de PRISMASOL 2 mmol/L POTASSIUM à administrer dépendent de la concentration sanguine d’électrolytes, de l’équilibre acido-basique et de l’état clinique général du patient. L’administration de la solution PRISMASOL 2 mmol/L POTASSIUM (dose, débit de perfusion et volume cumulatif) doit être définie par un médecin.
Les débits usuels de solution de substitution en hémofiltration et hémodiafiltration sont les suivants :
Adultes : 500 – 3 000 mL/h
Les débits usuels de solution de dialyse (dialysat) en hémodialyse continue et hémodiafiltration continue sont les suivants :
Adultes : 500 – 2 500 mL/h
Le débit généralement utilisé chez l’adulte est d’approximativement 2 000 à 2 500 ml/h, ce qui correspond à un volume quotidien de liquide d’approximativement 48 à 60 L.
Population pédiatriqueLes débits de solution de substitution en hémofiltration et en hémodiafiltration et les débits de solution de dialyse (dialysat) en hémodialyse continue sont les suivants :
Enfants (de nouveau-nés jusqu’aux enfants de moins de 18 ans) : 1 000 à 2 000 ml/h/1,73 m2.
Il pourra être nécessaire d’utiliser des débits jusqu’à 4 000 mL/h/1,73 m2, notamment chez les jeunes enfants (≤ 10 kg). Le débit absolu (en mL/h) utilisé dans la population pédiatrique ne doit généralement pas dépasser le débit maximal utilisé chez les adultes.
Instructions d’utilisation / de manipulationLa solution d’électrolytes (petit compartiment A) est ajoutée à la solution tampon (grand compartiment B), après ouverture de la soudure pelable ou cassure du cône sécable et immédiatement avant son utilisation pour obtenir la solution reconstituée.
Utiliser la solution uniquement avec un équipement d’épuration extra-rénale extracorporel approprié.
Une technique aseptique doit être respectée tout au long de la manipulation et l’administration de la solution au patient.
Utiliser uniquement si le suremballage n’est pas endommagé, toutes les soudures sont intactes, la soudure pelable n’est pas ouverte ou le cône sécable n’est pas cassé et la solution est limpide. Appuyer fermement sur la poche pour vérifier l’absence de fuite. En cas de fuite, jetez immédiatement la solution car il est impossible d’en garantir la stérilité.
Le grand compartiment B est muni d’un site d’injection pour l’ajout éventuel d’autres médicaments, une fois la solution reconstituée. Il est de la responsabilité du médecin de juger de la compatibilité en cas d’ajout d’un autre médicament à PRISMASOL 2 mmol/L POTASSIUM. Il doit vérifier le changement éventuel de couleur et/ou une éventuelle précipitation, la présence de complexes insolubles ou de cristaux.
Avant d’ajouter un médicament, il convient de vérifier sa solubilité et sa stabilité dans une eau au pH correspondant à celui de PRISMASOL 2 mmol/L POTASSIUM (le pH de la solution reconstituée est compris entre 7 et 8,5). Il est possible que les additifs soient incompatibles. La notice d’utilisation relative au médicament à ajouter doit être consultée.
Éliminer tout liquide du site d’injection, maintenir la poche de haut en bas, injecter le médicament par le site d’injection et mélanger vigoureusement. La solution doit être administrée immédiatement. L’introduction et le mélange des additifs doit toujours être effectué avant de connecter la poche au circuit extracorporel.
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’un cône sécable est situé dans le connecteur luer, suivre les instructions pour l’utilisation suivantes
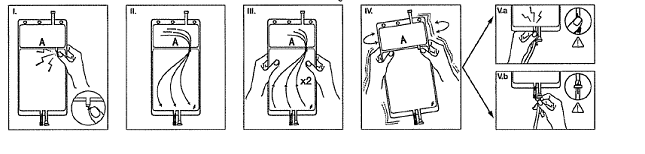
I Retirez le suremballage de la poche immédiatement avant usage. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône restera dans la poche (cf. figure I ci-dessous).
II Assurez-vous que toute la solution du petit compartiment A s’écoule dans le grand compartiment B (cf. figure II ci-dessous).
III Rincez deux fois le petit compartiment A en pressant la poche pour refouler la solution mélangée dans le petit compartiment A puis de nouveau dans le grand compartiment B (cf. figure III ci-dessous).
IV Lorsque le petit compartiment A est vide, agitez le grand compartiment B afin que le contenu soit bien mélangé. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure IV ci-dessous).
V La ligne de réinjection ou de dialysat peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
V. a Si le connecteur luer lock est utilisé, tout en respectant une technique aseptique, ôter le bouchon, visser le luer lock mâle de la ligne de dialysat ou de réinjection sur le luer lock femelle de la poche et serrer. Avec le pouce et les autres doigts, casser le cône sécable bleu à sa base avec un mouvement de va-et-vient. Ne pas utiliser d’instrument. Vérifier que le cône est complètement séparé et que le liquide s’écoule librement. Le cône sécable reste dans le luer pendant tout le traitement (cf. figure V.a ci-dessous).
V. b Si le site d’injection est utilisé : ôter la capsule. Puis introduire le trocard à travers la gomme du site d’injection. Vérifier que la solution s’écoule librement (cf. figure V.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
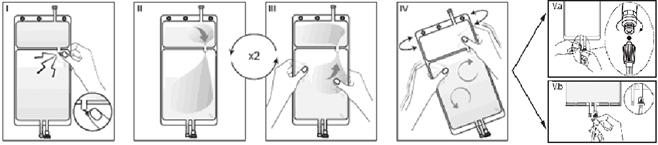
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’une valve est situé dans le connecteur luer, suivre les instructions pour l’utilisation suivantes
I Retirez le suremballage de la poche immédiatement avant usage. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône restera dans la poche (cf. figure I ci-dessous).
II Assurez-vous que toute la solution du petit compartiment A s’écoule dans le grand compartiment B (cf. figure II ci-dessous).
III Rincez deux fois le petit compartiment A en pressant la poche pour refouler la solution mélangée dans le petit compartiment A puis de nouveau dans le grand compartiment B (cf. figure III ci-dessous).
IV Lorsque le petit compartiment A est vide, agitez le grand compartiment B afin que le contenu soit bien mélangé. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure IV ci-dessous).
V La ligne de solution de réinjection ou de dialyse peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
V. a Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tirant et en le tournant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est sure et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration V.a ci-dessous)
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est écouvillonnable.
V. b Si le site d’injection est utilisé : ôter la capsule. Puis introduire le trocard à travers la gomme du site d’injection. Vérifier que la solution s’écoule librement (cf. figure V.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
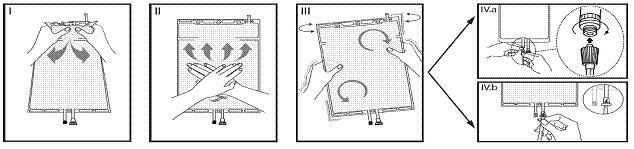
Si les deux compartiments de la poche sont séparés par une soudure pelable et qu’une valve est située dans le connecteur luer, suivre les instructions pour l’utilisation suivantes :
I Retirez le suremballage de la poche immédiatement avant usage. Mélangez les solutions des 2 compartiments. Ouvrez la soudure pelable en maintenant le petit compartiment des deux mains et en le pressant jusqu'à ce qu'une ouverture se crée dans la soudure pelable située entre les deux compartiments (cf. figure I ci-dessous).
II Appuyez des deux mains sur le grand compartiment jusqu'à ce que la soudure pelable inter-compartiments soit entièrement ouverte (cf. figure II ci-dessous).
III Mélangez bien la solution en secouant délicatement la poche. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure III ci-dessous)
IV La ligne de solution de réinjection ou de dialyse peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
IV. a Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le connecteur luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est sure et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration IV.a ci-dessous)
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est écouvillonnable.
IV. b Si le site d’injection est utilisé : ôter la capsule. Puis introduire le perforateur à travers la gomme du site d’injection. Vérifier que la solution s’écoule librement (cf. figure IV.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.